| 氧氣的性質和用途之一 |
| 作者:浙江省杭州市學軍中學 陳士良 |
|
教學目標 1.認識氧氣的物理、化學性質,了解氧氣的用途。 2.掌握化合反應的概念,初步了解氧化反應。 3.通過氧氣性質的課堂實驗,培養學生觀察能力和分析綜合能力,使他們初步懂得用實驗手段來研究物質性質的科學方法。 教學過程 展示三瓶未知氣體,觀察顏色、嗅氣味并記錄。(未知氣體是氮氣、二氧化碳和氧氣。記錄表在課前準備。)
這三種未知氣體各是什么?請看實驗,并記錄現象。 【教師演示】
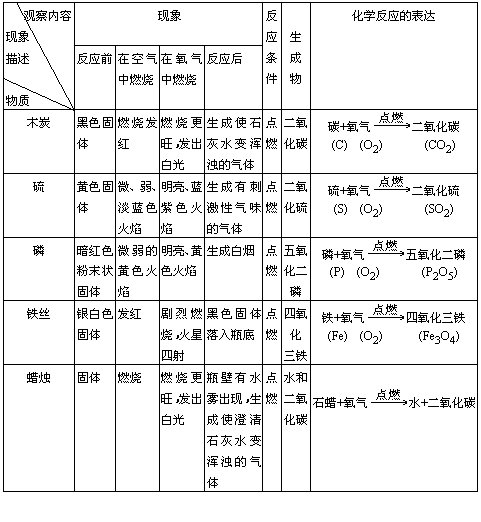
【講述】 能使有余燼木條重新燃燒的是氧氣(O2),能使澄清石灰水變渾濁的氣體是二氧化碳(CO2),另一瓶不能用簡單方法檢出的氣體是氮氣(N2)。 【引言】氧氣、氮氣、二氧化碳氣體都是空氣的組成成分。其中氧氣按體積計約占1/5,它跟人類生活、生產關系密切,是人類維持生命不可缺少的物質。 【揭示課題】氧氣的性質和用途(板書) 你每時每刻都要接觸氧氣、使用氧氣,你能描述它的哪些性質? 一、氧氣的物理性質(板書)。 色______,狀態_______,氣味______。 【閱讀】閱讀課本,了解氧氣的密度、熔點、沸點和在水中的溶解性等物理性質。 指出氣體的密度跟溫度、壓強有關,氣體的熔點、沸點及其在水中的溶解性跟壓強有關。 二、氧氣的化學性質(板書) 【演示實驗】 1.木炭在氧氣中燃燒,2.硫在氧氣中燃燒,3.磷在氧氣中燃燒,4.鐵絲在氧氣中燃燒。 觀察要點: ①反應物的狀態和色澤;②物質在空氣中和在氧氣中燃燒的不同點,③反應條件及現象描述,④在反應中的能量變化,⑤生成物的狀態及檢驗。 (要求學生仔細觀察,逐項填入下表。) 【投影】 物質和氧氣反應記錄表
(實驗中教師邊演示邊逐項引導,并突出下列要點。) ①反應物需要點燃。 ②能量變化表現在產生光和熱。 ③硫、磷燃燒有火焰,而碳、鐵灼熱發白光。 ④硫燃燒時生成有刺激性氣味的氣體,磷燃燒時有白煙生成,鐵燃燒時生成球狀固體(有液滴形成)。 ⑤生成物都是一種物質。 【小結】非金屬和金屬差不多都能跟氧氣劇烈反應,產生光和熱。 【討論】上述物質和氧氣反應的共同點是什么? 【小結】1.它們都有兩種物質參加反應,其中一種是氧氣。 2.它們都只生成一種物質。 【閱讀】課本 【板書】化合反應:兩種或兩種以上物質生成另一種物質的反應。 判斷是不是化合反應,要看生成物是否只有一種物質。 簡述其他共同點:點燃、產生光和熱。 【討論】上述物質跟氧氣反應有哪些不同點? 【小結】硫、磷燃燒有火焰,而木炭、鐵絲燃燒無火焰。反應中燃燒有無火焰,看燃燒物是否是氣體或蒸氣。硫、磷的沸點低,它們先氣化成蒸氣再燃燒,因此有火焰。而碳、鐵沸點高,在這一溫度下并不氣化,所以只看到灼熱的白光。 【討論】課本習題 【實驗作業】在你的桌上有三支試管,分別裝有氮氣、空氣和氧氣,請你檢驗出哪一瓶內裝氧氣。 【小結】可用帶火星的木條檢驗氧氣。 【思考】能否用一個實驗把氧氣、空氣同時檢驗出來? 【引言】前面都是單質和氧氣的反應,很多化合物也能在氧氣中燃燒。 【演示】5.蠟燭(含碳、氫成分的石蠟)在氧氣中燃燒(請你仔細觀察,把現象記錄好。)
【討論】這反應是不是化合反應,為什么? (不是,生成物有兩種。) 這個反應和前面物質和氧氣反應的共同之處是什么? (它們都是物質跟氧氣反應,都要有點燃的反應條件,燃燒時都伴隨光和熱。) 【小結】物質和氧的反應叫氧化反應。(板書) 判斷是不是氧化反應,只要看有沒有氧(不一定是氧氣)參加。前面一些反應既是化合反應,又是氧化反應。 【討論】通過上面的實驗,你對氧氣的性質有怎樣的認識? (氧氣是化學性質比較活潑的氣體,在氧化反應中提供氧,具有氧化性。) 【講解】通過對氧氣性質的了解,我們就可以進一步了解氧氣的用途。 【板書】三、氧氣的用途 【閱讀課文】(略) 【討論、小結】l.供給呼吸、維持生命和支持燃燒。 2.氧氣易跟其他物質反應,放出熱量,因此用于煉鋼、焊接、切割金屬,也可作火箭燃料的氧化劑等。 【作業】(略) 教學說明 (略) 專家講評 用展示的未知氣體作為問題情景,通過演示、檢驗引入教學課題,頗有新意。 在做演示實驗時,作者強調實驗的觀察要點,這為講解教學內容奠定基礎,也對落實“雙基”、培養能力作好必要的準備。 本教案寫得很實在,啟發、引導、討論和小結運用得當,在變更教學方式中能明顯感受師生在課堂教學中積極交流的活躍氣氛。 |